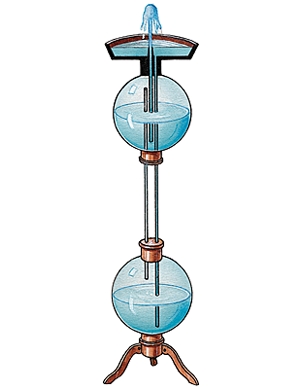
Ce mois-ci, un article de Pour la Science permet d'illustrer la leçon sur la Statique des fluides que nous avons terminée cette semaine.
Bonne lecture ;-)
/image%2F1488804%2F20160903%2Fob_a9643d_accueil-snnopy-wodstock.gif)
Ce mois-ci, un article de Pour la Science permet d'illustrer la leçon sur la Statique des fluides que nous avons terminée cette semaine.
Bonne lecture ;-)

Séminaire d'histoire des sciences "La puissance du feu"
28-29 novembre 2012
Les instruments de la thermodynamique
Jean-Pierre Grolier (Université Blaise Pascal de Clermont-Ferrand)

Max Planck en 1878, tout jeune étudiant (20 ans)
de l'université de Berlin dans le tout récent institut de physique d'Helmoltz
« Cherchant à étancher sa “soif de connaissances scientifiques avancées”, il [Max Planck] découvrit [en 1878] les travaux de Rudolf Clausius, un physicien de cinquante-six ans qui enseignait à l’université de Bonn.
Planck fut immédiatement subjugué par “le style lucide” de Clausius “et la clarté lumineuse de son rai¬sonnement” […]. Son enthousiasme pour la physique lui revint lorsqu’il parcourut les écrits de Clausius sur la thermodynamique. Les fondements de cette science qui s’intéresse à la chaleur et à ses rapports avec d’autres formes d’énergie se résumaient à l’époque en [29] deux principes seulement. Le premier était une rigou¬reuse formulation du fait que l’énergie, quelle que soit sa forme, possédait la propriété particulière de se conserver. L’énergie ne pouvait être ni créée ni détruite, mais uni¬quement convertie d’une forme en une autre. Une pomme suspendue à une branche d’arbre possède une énergie potentielle en vertu de sa position dans le champ gravitationnel de la Terre, sa hauteur au-dessus du sol. Lorsqu’elle tombe, l’énergie potentielle de la pomme est convertie en énergie cinétique, l’énergie du mouvement. Planck était lycéen lorsqu’il découvrit pour la première fois le principe de la conservation de l’énergie. Il le frappa “comme une révélation”, parce qu’il possédait “une validité absolue, universelle, indépendamment de toute action humaine”. C’est à ce moment qu’il entrevit l’éternité et qu’il commença à considérer la recherche des lois fondamentales ou absolues de la nature “comme la quête scientifique la plus sublime qui soit dans la vie”. Il fut tout autant fasciné quand il lut ensuite la formulation donnée par Clausius du deuxième principe de la thermodynamique : “La chaleur ne passera pas spontanément d’un corps plus froid à un corps plus chaud.” L’invention ultérieure du réfrigérateur démontra ce que Clausius voulait dire par “spontanément”. Le réfrigérateur a besoin d’être branché sur une source externe d’énergie – électrique, en l’occurrence – pour faire passer la chaleur d’un corps plus froid à un corps plus chaud.
Planck comprit que Clausius ne se contentait pas d’énoncer une évidence, mais quelque chose de bien plus profond. La chaleur, transfert d’énergie de A à B en vertu d’une différence de température, expliquait des phénomènes familiers comme une tasse de café chaud qui se refroidit ou un cube de glace qui fond dans un verre d’eau. Mais, sans intervention humaine, l’inverse ne se [30] produisait jamais. Pourquoi pas ? Le principe de la conservation de l’énergie ne s’oppose pas à ce qu’une tasse de café se réchauffe et que l’air environnant se refroidisse, ou que l’eau du verre se réchauffe et que le glaçon se refroidisse. Il ne s’opposait pas à ce que la chaleur passe spontanément d’un corps froid à un corps chaud. Toutefois, quelque chose empêchait que le phé¬nomène se produise. Clausius découvrit cette entité et la nomma entropie. Elle était au cœur des raisons qui font que certains processus se produisent dans la nature et d’autres non.
Lorsqu’une tasse de café chaud se refroidit, l’air environnant se réchauffe tandis que l’énergie se dissipe et se perd irrémédiablement, assurant ainsi que le processus inverse ne peut se produire. Si la conservation de l’énergie était la manière dont la nature équilibre son bilan dans toute transaction physique possible, la nature exigerait alors un prix pour toute transaction qui se produirait effectivement. D’après Clausius, l’entropie était le prix à payer pour qu’il se produise quelque chose ou non. Dans tout système isolé, seuls étaient autorisés les processus ou transactions dans lesquels l’entropie soit restait la même, soit augmentait. Tout processus conduisant à une dimi¬nution de l’entropie était strictement interdit.
Clausius définit l’entropie comme la quantité de chaleur qui entre dans un corps ou un système ou qui en sort, divisée par la température à laquelle se produit le processus. Si un corps chauffé à 500 degrés perd 1000 unités d’énergie au profit d’un corps plus froid, alors son entropie a diminué de –1000/500 = –2. Le corps froid à 250 degrés a gagné 1000 unités d’énergie et son entropie a augmenté de +1000/250 = 4. L’entropie générale du système – les corps chaud et froid combinés – a augmenté de 2 unités d’énergie par degré. Tous les processus réels sont irréversibles parce qu’ils [31] entraînent un accroissement de l’entropie. C’est la manière dont la nature s’arrange pour que la chaleur ne passe pas spontanément d’un objet froid à un objet chaud. Seuls des processus idéaux dans lesquels l’entropie reste inchangée sont réversibles. Toutefois, ils ne se produisent jamais dans la pratique, mais seulement dans l’imagination des physiciens. L’entropie de l’Univers tend vers un maximum. Avec l’énergie, Planck finit par considérer l’entropie comme “la propriété la plus importante des systèmes physiques”. »
Manjit Kumar,
Le Grand roman de la physique quantique,Paris, Flammarion, 2012,
.
Merci à Jérôme ;-)
• Concernant les leçons T5 et T6, six nouveaux sujets et leurs corrigés sont désormais en ligne dans la section Devoirs à travailler à la maison.
• Egalement en ligne, dans les archives des années passées, les corrigés de la majorité des exercices de la leçon T6 :
à travailler une petit peu chaque jour pour bien assimiler les différentes méthodes et principes,
bonnes révisions !
Merci à Maxime et à Jérôme ;-)
• Ex-T3.15 : Méthode de Clément-Desormes
• Ex-T3.16 : Méthod de Rückardt
• Ex-T4.4 : Chauffage d'un gaz par une résistance / Bilan entropique